RADIACTIVIDAD
Aquí tenéis un video sobre la radiactividad que os va a aclarar muchas dudas sobre este fenómeno.
Aquí tenéis un video sobre la radiactividad que os va a aclarar muchas dudas sobre este fenómeno.

Marie Curie ha sido, quizás, la mujer más excepcional del siglo XX y de la historia de la Ciencia.
Marie fue una mujer delgada, pequeña, prematuramente envejecida por el maltrato de la exposición continuada a la radiación, tímida, seria y ausente en algunos casos.
Marie Curie fue la "primera":
- La primera de la promoción en la carrera de Física.
- La primera mujer en doctorarse en Francia.
- La primera mujer en obtener un Premio Nobel.
- La primera mujer en obtener una Cátedra en la Sorbona.
- El/La primer/a científico/a en obtener dos Premios Nobel.
Hoy os cuento esto porque pronto realizaremos una actividad sobre científicos importantes y cuyas investigaciones y descubrimientos han sido de suma importancia para la humanidad. Una de ellas fue Mare Curie, pronto sabremos más cosas...
También denominados sistemas tampón o " buffer".
Son la primera línea de defensa ante los cambios de pH gracias a la capacidad que tienen para captar o liberar protones de modo inmediato. Los organismos vivos soportan muy mal las variaciones del pH, aunque tan solo se trate de unas décimas de unidad, y por ello han desarrollado en la historia de la evolución sistemas tampón buffer que mantienen el pH constante, mediante mecanismos homeostáticos. Las variaciones de pH, afectan a la estabilidad de las proteínas y, en concreto, en la actividad catalítica de los enzimas, pues en función del pH, pueden generar cargas eléctricas que modifiquen su actividad biológica.
Un sistema tampón es una solución de un ácido débil y su base conjugada:
AH (ácido) H+ + A-(base)
La constante de disociación del ácido (K) viene expresada como:
K= [H+][A-] / [AH]
El valor de pH en el cual el ácido se encuentra disociado en un 50% se conoce como pK (pK = -log[K]).
El pK representa el valor de pH en el que un sistema tampón puede alcanzar su máxima capacidad amortiguadora.
Cada sistema buffer tiene un valor de pK característico.
Buenos amortiguadores serán aquellos cuyo pK esté próximo a 7.4.
Los amortiguadores más significativos y de mayor importancia para los seres vivos son:
Amortiguador fosfato.-
Ejerce su acción fundamentalmente a nivel intracelular, ya que es allí donde existe una mayor concentración de fosfatos y el pH es más próximo a su pK (6.8).
Interviene, junto a las proteínas celulares de manera importante en la amortiguación de los ácidos fijos:
PO4H2- PO4H-+ H+Amortiguador carbónico/bicarbonato.-
Poco potente desde el punto de vista químico, (pK = 6.1).
Es el tampón más importante en la homeostasis del pH
porque:
- Está presente en todos los medios tanto
intracelulares como extracelulares. En el medio extracelular la concentración de bicarbonato es elevada (24 mEq).
- Es un sistema abierto. La concentración de cada uno de los dos elementos que lo componen son regulables; el CO2 a nivel pulmonar, y el bicarbonato a nivel renal.
- La suma de las concentraciones del ácido y de la base no es constante, lo cual aumenta muchísimo su capacidad amortiguadora.
CO2+ H2OCO3H2H++ HCO3-
La relación entre el ácido y la base viene dada por la ecuación de Henderson-Hasselbalch:
pH = pK + Log [HCO3-] / [H2CO3]
Si consideramos el pH sanguíneo normal 7.4, y el pKdel sistema 6.1, al aplicarlo a la fórmula obtendremos la relación entre la concentración de bicarbonato y de ácido carbónico:
7.4 = 6.1 + log [HCO3-] / [H2CO3]log [HCO3-] / [H2CO3] = 1.3

LLUVIA ÁCIDA
La lluvia ácida se forma cuando la humedad en el aire se combina con el óxido de nitrógeno y el dióxido de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados del petróleo. En interacción con el vapor de agua, estos gases forman ácido sulfúrico y ácidos nítricos. Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes distancias, trasladándolos los vientos cientos o miles de kilómetros antes de precipitar en forma de rocío, lluvia, llovizna, granizo, nieve o niebla. Cuando la precipitación se produce, puede provocar importantes deterioros en el ambiente.La lluvia normalmente presenta un pH de aproximadamente 5.6 (ligeramente ácido) debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH de menos de 5 y puede alcanzar el pH del vinagre (pH 3). Estos valores de pH se alcanzan por la presencia de ácidos como el ácido sulfúrico, H2SO4, y el ácido nítrico, HNO3. Estos ácidos se forman a partir del dióxido de azufre, SO2, y el monóxido de nitrógeno que se convierten en ácidos. Los hidrocarburos y el carbón usados como fuente de energía, en grandes cantidades, pueden también producir óxidos de azufre y nitrógeno y el dióxido de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados del petróleo. En interacción con el vapor de agua, estos gases forman ácido sulfúrico y ácidos nítricos. Finalmente, estas sustancias químicas suben a la atmósfera forman una nube y después caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.
FORMACIÓN DE LA LLUVIA ÁCIDA
Una gran parte del SO2 (dióxido de azufre) emitido a la atmósfera procede de la emisión natural que se produce por las erupciones volcánicas, que son fenómenos irregulares. Sin embargo, una de las fuentes de SO2 es la industria metalúrgica.El SO2 puede proceder también de otras fuentes, por ejemplo como el sulfuro de dimetilo, (CH3)2S, y otros derivados, o como sulfuro de hidrógeno, H2S. Estos compuestos se oxidan con el oxígeno atmosférico dando SO2.Finalmente el SO2 se oxida a SO3 (interviniendo en la reacción radicales hidroxilo y oxígeno) y este SO3 se puede quedar disuelto en las gotas de lluvia, es el de las emisiones de SO2 en procesos de obtención de energía: el carbón, el petróleo y otros combustibles fósiles contienen azufre en unas cantidades variables (generalmente más del 1%), y, debido a la combustión, el azufre se oxida a dióxidos de azufre:S + O2 → SO2 Hay otros procesos industriales en los que también se genera SO2, por ejemplo en la industria metalúrgica.Este SO3 se puede quedar disuelto en las gotas de lluvia, en forma de H2SO4. La reacción global es:SO2 + OH· + O2 + nH2O → HOO· + H2SO4(ac) También se puede despositar sobre superficies húmedas.El NO se forma por reacción entre el oxígeno y el nitrógeno a alta temperatura:O2 + N2 → 2NO Una de las fuentes más importantes es a partir de las reacciones producidas en los vehículos de los automóviles y aviones. Este NO se oxida con el oxígeno atmosférico:O2 + 2NO → 2NO2 Y este 2NO2 reacciona con el agua dando ácido nítrico que se disuelve en el agua:3NO2 + H2O → 2HNO3 + NO
EFECTOS DE LA LLUVIA ÁCIDA
La acidificación de las aguas de lagos, ríos y mares dificulta el desarrollo de vida acuática en estas aguas aumentando en gran medida la mortandad de peces. Igualmente, afecta directamente a la vegetación, produciendo daños importantes en las zonas forestales, así como acabando con microorganismos fijadores de N.La lluvia ácida, por su carácter corrosivo, corroe a las construcciones y las infraestructuras. Puede disolver, por ejemplo, el carbonato de calcio, CaCO3, afectando de esta forma a los monumentos y edificaciones construidas con mármol o caliza.Un efecto indirecto muy importante es que los protones, H+, procedentes de la lluvia ácida lixivian (arrastran) ciertos iones del suelo. Por ejemplo, cationes de hierro, calcio, aluminio, plomo, zinc, Como consecuencia se produce un empobrecimiento en ciertos nutrientes esenciales y el denominado estrés en las plantas, que las hace más vulnerables a las plagas.Los nitratos y sulfatos, sumados a los cationes lixiviados de los suelos, contribuyen a la eutrofización de ríos y lagos, embalses y regiones costeras, deteriorando sus condiciones ambientales naturales y afectando negativamente a su aprovechamiento.Un estudio reciente por Vincent Gauci de The Open University, sugiere que cantidades relativamente pequeñas de sulfato presentes en la lluvia ácida tienen una fuerte influencia en la reducción de gas metano producido por metanógenos en áreas pantanosas, lo cual podría tener un impacto, aunque sea leve, en el efecto invernadero.
SOLUCIONES PARA LA LLUVIA ÁCIDA
Entre las medidas que se pueden tomar para reducir la emisión de los contaminantes precursores de éste problema tenemos las siguientes:
El Lunes día 31 de Marzo tendrá lugar el examen de Formulación Orgánica. Como todos sabéis las clases finalizaron el Jueves día 13 de Marzo y no el Lunes día 10 por lo que se ha seguido avanzando materia durante esta semana y haciendo ejercicios prácticos de formulación, pese al absentismo en estos días.
Para los 3 alumnos que fueron de viaje de estudios, durante la semana de vuelta de vacaciones me pueden encontrar en el Departamento de Física y Química para aclarar dudas. El resto tendrán que conseguir los apuntes de clase y realizar los ejercicios.
Espero que esta ausencia a clase de forma injustificada no vuelva a ocurrir en alumnos de Bachillerato.
Científicos de la Universidad de Granada han descubierto que el ácido maslínico, presente en la hoja y cera de la piel de la oliva, actúa sobre las células tumorales controlando sus alteraciones en los procesos de crecimiento. En la actualidad, la única planta de producción de esta sustancia a nivel semi-industrial que hay en todo el mundo se encuentra en la Facultad de Ciencias de la UGR. Un grupo de investigadores de la Universidad de Granada han descubierto que el ácido maslínico, un compuesto presente en la hoja y en la cera de la piel de la aceituna que se extrae del alpeorujo, tiene la capacidad de prevenir la aparición de cáncer, así como de regular la apoptosis en los procesos cancerígenos.
El ácido maslínico es un inhibidor de proteasas que, entre otras propiedades, posee la capacidad de regular el crecimiento celular. Es ahí donde radica su utilidad en el tratamiento contra el cáncer, ya que permite controlar los procesos de hiperplasia e hipertrofia propios de esta enfermedad. Los científicos de la UGR han caracterizado por primera vez la acción del ácido maslínico desde el punto de vista molecular cuando es aplicado al desarrollo de células tumorales. Este trabajo ha sido realizado por el doctorando Fernando Jesús Reyes Zurita, y dirigido por el profesor José Antonio Lupiáñez Cara, del departamento de Bioquímica y Biología Molecular I y la profesora Marta Cascante Serratosa de la Universidad de Barcelona. A juicio de ambos científicos, las ventajas del ácido maslínico son tres: a diferencia de otros productos anticancerígenos, altamente citotóxicos, se trata de un compuesto natural y por tanto de menor toxicidad. Además, es selectivo, es decir, actúa sólo sobre las células cancerígenas, cuyo pH es más ácido de lo normal. Y en último lugar, posee un carácter preventivo, ya que es capaz de inhibir la aparición del cáncer, en aquellas células que tienen una mayor predisposición de desarrollarlo.
Para todo tipo de cáncer
Aunque el grupo de investigación del profesor Lupiáñez Cara ha analizado el efecto del ácido maslínico en el tratamiento del cáncer de colon, si bien podría emplearse en un amplio número de tumores. De momento, sus investigaciones se han realizado en líneas de carcinomas de colon y en ratones transgénicos, pero no descartan poder aplicarlas a humanos en un futuro.
El ácido maslínico es un terpeno pentacíclico que además de ser anticancerígeno posee efectos antiinflamatorios y antioxidantes, y que se encuentra en elevadas concentraciones en la cera de la piel de la aceituna. En la actualidad, la única planta de producción de esta sustancia a nivel semi-industrial que hay en todo el mundo se encuentra en la Facultad de Ciencias de la Universidad de Granada. (Para ver el video sobre la investigación:http://prensa.ugr.es/prensa/investigacion/verNota/prensa.php?nota=4276) Lidia Morales Ruiz 2º BCH
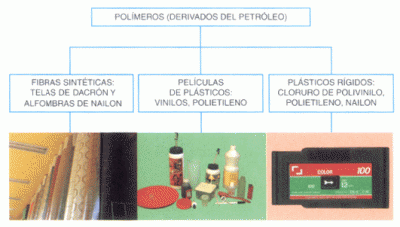
Polímeros artificiales
Los polímeros son compuestos químicos cuyas moléculas están formadas por la unión de otras moléculas más pequeñas llamadas monómeros. Estas cadenas, que en ocasiones presentan también ramificaciones o entrecruzamientos, pueden llegar a alcanzar un gran tamaño, razón por la cual son también conocidas con el nombre de macromoléculas. Habitualmente los polímeros reciben, de forma incorrecta, el nombre de plásticos, que en realidad corresponde tan sólo a un tipo específico de polímeros, concretamente los que presentan propiedades plásticas (blandos, deformables y maleables con el calor).
Dependiendo de su origen, los polímeros pueden clasificarse en naturales y artificiales. Entre los naturales se hallan sustancias muy comunes de las que suele ignorarse su naturaleza polimérica: Los hidratos de carbono o polisacáridos, como el almidón o la celulosa; la lana, la seda y otras proteínas, constituidas por aminóacidos; los ácidos nucleicos (el ADN y el ARN), responsables de la información genética, cuyos monómeros constituyentes son un azúcar (ribosa o desoxirribosa), ácido fosfórico y las bases nitrogenadas que constituyen las letras del código genético, y otras sustancias tales como el caucho, derivadas de pequeñas moléculas de hidrocarburos.
Con el desarrollo de la tecnología y la industria química el hombre ha aprendido a imitar a la naturaleza, e incluso a mejorarla, sintetizando nuevos polímeros artificiales inexistentes en ella, normalmente a partir de derivados del petróleo. El primero en ser creado de forma totalmente artificial fue, en 1909, la baquelita, aunque con anterioridad se habían obtenido algunos, como el celuloide, mediante la modificación de polímeros naturales, celulosa en este caso. En la actualidad la síntesis y el procesado de materiales poliméricos es una de las más importantes ramas de la industria química, y los polímeros están presentes de forma habitual en nuestra vida cotidiana. Lo que distingue a los polímeros de los materiales constituidos por moléculas de tamaño normal son sus propiedades mecánicas. En general, los polímeros tienen una muy buena resistencia mecánica debido a que las grandes cadenas poliméricas se atraen. Las fuerzas de atracción intermoleculares dependen de la composición química del polímero y pueden ser de varias clases. Las más comunes, denominadas Fuerzas de Van der Waals. Sin pretender ser, ni mucho menos, exhaustivos podemos recordar algunos polímeros tan usuales y frecuentes como el polietileno y el polipropileno, utilizados para la elaboración de bolsas de plástico; el poliestireno, o corcho blanco, para embalajes; el PVC, o policloruro de vinilo, para envases y tuberías; el PET (polietilentereftalato), también para envases; el teflón, como aislante; las poliamidas (nailon) y los poliésteres (tergal), como fibras sintéticas; el metacrilato, como sustitutivo del vidrio; el caucho sintético, para neumáticos... También existen polímeros artificiales de naturaleza inorgánica, como las siliconas, donde el carbono ha sido sustituido por átomos de silicio encadenados con átomos de oxígeno. Los factores que han favorecido el mercado de los plásticos son los precios competitivos y a veces inferiores a los de los productos naturales, y el hecho de que el petróleo ofrece una mayor disponibilidad de materiales sintéticos que otras fuentes naturales. La crisis petrolera de 1974 también influyó en el aumento del consumo de los plásticos, sobre todo en la industria automotriz. Los plásticos permitían disminuir el peso de los vehículos, lo cual repercutía en un ahorro en el consumo de combustible por kilómetro recorrido. Entre los polímeros usados para reducir el peso de los automóviles se encuentran los poliésteres, polipropileno, cloruro de polivinilo, poliuretanos, polietileno, nylon y ABS (acrilonitrilo-butadienoestireno). Sin embargo, el mercado más grande de los plásticos es el de los empaques y embalajes.
Como es fácil apreciar, la vida actual no sería imaginable sin los materiales poliméricos, tal es su implantación en nuestra sociedad. A las aplicaciones beneficiosas de los polímeros sintéticos hay que añadir el grave problema que crea su resistencia a la degradación una vez usados, lo que dificulta su eliminación e incluso su reciclado. Aunque actualmente se está intentando sustituir los polímeros más perniciosos, como el PVC y en general los que contienen flúor y cloro, por otros más inocuos, y se ha comenzado a implantar polímeros biodegradables, todavía hoy un porcentaje muy importante de nuestras basuras está constituido por polímeros de difícil eliminación.
Ana Cerezo Hernández – 2º Bchto

Como ya es sabido, el 29 de Febrero se celebró en la Facultad de Ciencias Químicas la XIII Olimpiada de Química en su fase local en la que participaron cinco alumnas de nuestro centro: Ana Cerezo, Jose Cerezo, Ana Victoria García, Lidia Morales y Cristina Sánchez.
Estas alumnas fueron seleccionadas del grupo de Química de 2º de Bachillerato por sus buenas notas y su brillante trabajo en esta asignatura.
Al igual que en las Olimpiadas deportivas los participantes han tenido que demostrar su valía en duras pruebas (cuestionarios, problemas, supuestos prácticos) y aunque no han conseguido superarlas todas, desde aquí quiero felicitarlas y valorar de forma muy positiva la participación en este evento. Creo que ha servido para acercarlas a ese mundo que les espera el año que viene (la Universidad) y conocer la Facultad de Química, laboratorios, biblioteca, aularios, así como su estupenda cafetería que sirvió un suculento aperitivo a todos los participantes.
¡Enhorabuena a los ganadores! ¡El año que viene nos prepararemos más y mejor!

Para los que se quieren iniciar en el fascinante mundo de la observación del cielo os diré que no necesitáis un potente telescopio, a simple vista o con unos prismáticos os daréis cuenta de las maravillas que nos rodean.
El cielo de invierno es especialmente bonito y podemos ver constelaciones, planetas, nebulosas, lluvia de estrellas y todo esto mirando el firmamento a simple vista.![]()
Seguro que habéis visto alguna vez tres estrella juntas y alineadas, es el cinturón de Orión, una constelación con forma de cazador cuya cabeza es una estrella rojiza llamada Betelgeuse, su cinturón está formado por las tres estrellas alineadas y debajo de una de ellas se puede observar una nebulosa llamada “Nebulosa de Orión”. Como buen cazador Orión llevaba cerca siempre a un perro, esta es la constelación del Can Mayor cuya estrella más brillante se llama Sirio, es una de las más cercanas a la Tierra se encuentra a tan solo 8,6 años luz.![]()
Y para quien no encuentre el Norte deberá localizara a la estrella Polar que lo señala permanentemente, no esperéis una estrella muy brillante, cuesta un poco localizarla, se encuentra en la constelación de la Osa Menor y alrededor de ella se encuentra siempre Casiopea un conjunto de estrellas en forma de W.
En este mes en concreto se producirá un eclipse de Luna el día 21 de Febrero, y para aquellos que quieran ver cumplidos sus deseos les sugiero que miren al cielo el día 25, en el que se producirá una lluvia de estrellas, más conocida como las Leónidas por producirse en la constelación de Leo (ya sabéis cada estrella fugaz un deseo)
Si queréis más información sobre estos temas o ver fotos interesantes os recomiendo estas direcciones:
Y si queréis navegar por el espacio interestelar podéis bajaros de Internet de forma gratuita el programa CELESTIA ¡vais a alucinar!![]()

La Asociación de químicos de Murcia ha convocado la XIII Olimpiada de Química de la Región de Murcia, para todos los alumnos matriculados en Segundo Curso de Bachillerato.
Las pruebas de clasificación de la Fase Local se realizarán el 29 de Febrero viernes, a las 10:30 horas en la Facultad de Química del Campus de Espinardo.
Para participar sólo es necesario rellenar un formulario de inscripición que irá acompañado de un Certificado del Centro en el que se especifique que, el alumno participante, se encuentra matriculado en él y cumple los requisitos para presentarse a esta prueba.
En nuestro centro ya tenemos algunas candidatas para participar.
Prepararemos la Olimpiada en los recreos y en este sitio de internet os plantearé cuestiones y problemas para resolver en casa.
Están invitados a estas sesiones de preparación todos los alumnos de 2º de Bachillerato, seguro que será un trabajo positivo para preparar vuestra Selectividad.

"Nunca consideres el estudio como una obligación, sino como una oportunidad para penetrar en el bello y maravilloso mundo del saber"
"Si buscas resultados distintos, no hagas siempre lo mismo"
"Hay una fuerza motriz más poderosa que el vapor, la electricidad y la energía atómica: la voluntad".
"Comienza a manifestarse la madurez cuando sentimos que nuestra preocupación es mayor por los demás que por nosotros mismos".
"¡Triste época la nuestra! Es más fácil desintegrar un átomo que un prejuicio".
"Si mi teoría de la relatividad es exacta, los alemanes dirán que soy alemán y los franceses que soy ciudadano del mundo. Pero si no, los franceses dirán que soy alemán, y los alemanes que soy judío".
| Helio: He |
| Descubridor : Joseph Norman Lockyer(Inglés) y Pierre Jules César Jannsen (Francés) |
| Año : 1868 |
| Etimología : del griego helios (sol) |
|
| Neón: Ne |
| Descubridor : William Ramsay(1852-1916) y Morris W. Travers (Ingleses) |
| Año : 1898 |
| Etimología : del griego neos (nuevo) |
|
| Argón: Ar |
| Descubridor : William Ramsay(1852-1916) y John William Strutt(1842-1919) (barón Lord Rayleygh) (Ingleses) |
| Año : 1894 |
| Etimología : del griego argon (inerte, inactivo) |
| Criptón: Kr |
| Descubridor : William Ramsay(1852-1916) y Morris W. Travers (Ingleses) |
| Año : 1898 |
| Etimología : del griego kryptos (escondido) |
| Xenón: Xe |
| Descubridor : William Ramsay(1852-1916) y Morris W. Travers (Ingleses) |
| Año : 1898 |
| Etimología : del griego xenos (estranjero) |
| Radón : Rn | |
| Descubridor : Friedich Ernst Dorn(alemán) | |
| Año : 1900 | |
| Etimología : de radio (ver abajo) |

Un poco de Historia... Pero...
UN POCO DE HISTORIA...
El doctor H. Kamerlingh Onnes (1856 - 1926), de la Universidad de Leiden
en Holanda, trabajó a principios del Siglo XX en la investigación de las
propiedades de la materia a bajas temperaturas. Sus esfuerzos hicieron
posible la producción de helio líquido en 1908, y posteriormente le condujeron
al descubrimiento de la superconductividad en el mercurio al ser enfriado a
-269ºC. Por estos trabajos de investigación se le concedió el Premio Nobel
de Física en 1913. Pero hasta 1957 no se pudo comprender el origen de este
fenómeno. J. Bardeen, L. Cooper y R. Schrieffer enunciaron la teoría conocida
como BCS, en la que se postulaba que en un superconductor los entes que
transportaban la corriente eran parejas de electrones conocidos como pares
de Cooper. También ellos fueron galardonados con el Premio Nobel en 1972.
El último gran hito de la superconductividad tuvo lugar en 1986 cuando J. C.
Bednorz y K. A. Müller, en unos laboratorios de IBM en Suiza, descubrieron los
materiales superconductores cerámicos. Estos materiales han revolucionado
el mundo de la superconductividad al poder trabajar a temperaturas por
encima de la de ebullición del nitrógeno líquido (-169ºC), lo que permite
enfriarlos con mucha facilidad y de forma barata. Estos dos científicos también
recibieron el premio Nobel en 1987.
Estos materiales superconductores han logrado que aumente el
interés tecnológico para desarrollar un gran número de aplicaciones.
Sin olvidar la posibilidad de que en un futuro se puedan descubrir
materiales superconductores a temperatura ambiente, la comunidad
científica está realizando un gran esfuerzo para mejorar los sistemas
de refrigeración y lograr que sea una realidad que estos materiales se
integren en nuestras vidas.
PERO ¿QUÉ ES LA SUPERCONDUCTIVIDAD?
Para entender lo que se oculta tras ese nombre debemos intentar recordar
algunos conceptos básicos. Los metales son materiales que conducen bien
el calor y la electricidad, y que cuando una corriente eléctrica circula por un hilo
conductor, éste se calienta, como ocurre con las estufas y calentadores
eléctricos. El fenómeno descrito, conocido como efecto Joule, se debe a
que los metales presentan cierta resistencia al paso de la corriente eléctrica
por su interior, ya que cuando se mueven, chocan con los átomos
del material que están vibrando.
En un material superconductor esto no ocurre, estos materiales no ofrecen
ninguna resistencia al paso de la corriente eléctrica continua por
debajo de una cierta temperatura.
Los electrones se agrupan en parejas interaccionando con los átomos del
material de manera que logran sintonizar su movimiento con el de los átomos,
desplazándose sin chocar con ellos. Esto significa que no se calientan, por lo que
no hay pérdida de energía al transportar la corriente eléctrica
debido al efecto Joule.
El descubrimiento de la superconductividad es uno de los más sorprendentes
de la historia de la ciencia moderna.
ALGUNAS APLICACIONES DE LOS SUPERCONDUCTORES.
MATERIALES SUPERCONDUCTORES. LA PRODUCCIÓN DE GRANDES CAMPOS MAGNÉTICOS.

Un ejemplo de la aplicación de estos grandes campos magnéticos son los equipos
de resonancia magnética que se utilizan en investigación y los comúnmente
utilizados en los hospitales.
Los superconductores permiten conducir la corriente eléctrica sin pérdidas,
por lo que pueden transportar densidades de corriente por encima de 2000
veces lo que transporta un cable de cobre.
Si contásemos con generadores, líneas de transmisión y transformadores
basados en superconductores, obtendríamos un gran aumento de la eficiencia,
con el consecuente beneficio medioambiental que supondría el ahorro de
combustible, así como su idoneidad para ser utilizado, junto con energías alternativas.
También podemos encontrar materiales superconductores en dispositivos electrónicos.
Entre ellos destacan los llamados SQUIDS, con los que podemos detectar campos
magnéticos inferiores a una mil millonésima parte del campo magnético terrestre.
Entre otras aplicaciones, se están desarrollando con ellos estudios geológicos, o incluso
encefalogramas sin necesidad de tocar la cabeza del enfermo.
Un material superconductor no solamente no presenta resistencia al paso de
corriente, sino que también tiene otra propiedad importante que es su
capacidad para apantallar un campo magnético.
Si enfriamos el superconductor por debajo de su temperatura crítica
y lo colocamos en presencia de un campo magnético, éste crea corrientes de
apantallamiento capaces de generar un campo magnético opuesto al aplicado.
Esto ocurre hasta que el campo magnético alcanza un valor, llamado
campo crítico, momento en el que el superconductor deja de apantallar el
campo magnético y el material transita a su estado normal.
El hecho de que el superconductor pueda apantallar totalmente el campo
magnético de su interior se conoce como supercondutividad tipo I.
Lamentablemente el campo crítico de estos materiales es tan pequeño que no se pueden desarrollar
aplicaciones tecnológicas con ellos.
Los superconductores tipo II permiten que el campo magnético pueda penetrar
en su interior sin dejar de ser superconductores.
Este comportamiento se mantiene para campos magnéticos cuyo valor
puede ser hasta varios millones de veces el campo magnético terrestre.
Los superconductores tipo I siempre intentan expulsar el campo
magnético de su interior, los de tipo II se oponen a que éste cambie.
ASÍ FUNCIONA EL TREN DE LEVITACIÓN...

Al colocar un material superconductor a temperatura ambiente sobre una
configuración de imanes, el campo magnético penetra totalmente en el
superconductor.
Después de enfriarlo con nitrógeno líquido y alcanzar la temperatura crítica, es
decir, el estado superconductor, casi todo el campo magnético permanece dentro
del superconductor, es decir “recuerda” el campo en el que ha sido enfriado y
se opone a cualquier variación del mismo. Si en este estado tratamos de alejarlo
del imán, encontraremos una fuerza atractiva entre ambos, de manera que el
superconductor arrastrará al imán.
Si hemos colocado el superconductor a una cierta altura sobre el imán y lo
enfriamos, éste no sólo recordará el campo, sino también la altura, en la que se
mantendrá levitando mientras esté por debajo de la temperatura crítica.
Esta propiedad, la levitación, en la que se evita el rozamiento con las vías,
ya se está aplicando en Japón donde han fabricado un prototipo de tren basado
en levitación con superconductores y que ha podido alcanzar los 550 km/h.
Estudiar.
Esta es la respuesta que nos da un conocido anuncio de televisión a la pregunta anterior. Pero yo me pregunto ¿dónde están nuestros futuros médicos, ingenieros, enfermeros, biólogos, químicos, arquitéctos, informáticos, investigadores en busca de soluciones a nuestros problemas...si nadie "se atreve" a estudiar CIENCIA?.
Este artículo va dedicado a esos valientes 12 alumnos de 1º de Bachillerato del instituto Sanje que han osado hacer frente a las opiniones de muchos:"dónde te vas a meter" "en ciencias tienes que estudiar un montón" "no vas a aprobar" etc, etc. y que espero que en un futuro colaboren en el avance científico y tecnológico de esta sociedad.
Deseo que este rincón en Internet anime y ayude al resto de chicos y chicas a interesarse por la Ciencia y colabore en su formación con el objetivo de tener en un futuro no lejano buenos profesionales.
¡ÁNIMO!
Ya tienes weblog.
Para empezar a publicar artículos y administrar tu nueva bitácora:
Una vez dentro podrás:
Puedes eliminar este artículo (en Artículos > eliminar). ¡Que lo disfrutes!